
En este artículo vamos a tratar un tema antiguo como la Farma propia y ahora de nuevo de rabiosa actualidad, como es le tema del Switch de los productos de prescrípción con receta a productos OTC / EFP…; pero antes de entrar en materia y tratar mencionado asunto, recordaremos criterios fundamentales, como punto de salida, aunque casi todos los conozcamos:
1. No debemos confundir un Switch de una Desfinanciación; ya que mientras la primera es un acto voluntario por parte de un laboratoria titular de un medicamento, para pasarlo al estatus OTC, la segunda es un ac to gubernamental, mendiante la cual y por Decreto Ley, salen del sistema de financiación y reembolso, aquellos medicaments seleccionados.
2. Los productos OTC ( Over the Counter ) o EFP ( Especialidad Farmaceútica Publicitaria ) son medicamentos de venta libre, que no necesitan receta para su dispensación en la oficina de farmacia, y solo se pueden dispensar en d icho canal en España.
3. Los productos OTX son medicamentos que necesitan ser recetados por el medico mediante la conocida receta blanca, y que no esta sujeto al sistema de financiación y reembolso.
4. Fracción VI son medicamentos que para adquirirse no requieren receta médica y que pueden expenderse en otros establecimientos que no sean farmacias. No podrán venderse medicamentos u otros insumos para la salud en puestos semi- fijos, módulos móviles o ambulantes.
5. La decisión de decidir que principio activo es OTC o no, es potestad de cada pais europeo, quedando reflejado en las listas positivas existentes, como el extracto que presentamos seguidamente:
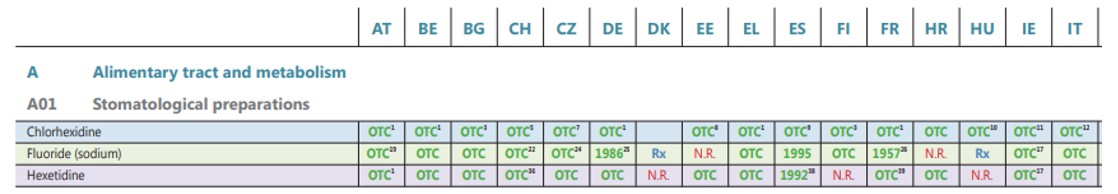
Bien, y mencionado elo, abordaremos el Switch de producto, desde el punto de vista de negocio y desde el punto de vista Legal/Regulatorio, los dos bloques fundamentales del asunto que nos atañe, y los grandes causantes del fracaso de los switchs…
Un buen planteamiento de negocio es el primer elemento y el básico para podet tener éxito en le mercado; sin una buena planificación y estrategia de desarrollo comercial, de megocio y marketing, estaremos abocados al fracaso.
Por ello debemos tener en cuenta las siguientes premisas:
1. Vamos a pasar un fármaco cuyo coste lo paga la mayoría el Gobierno, a costa de los Presupuestos Generales del Estado, a que lo paguemos integramente con dinero de nuestro bolsillo.
2. Generalmente el paso de Rx a OTC lleva asociado un gran incremento de precio por parte del laboratorio comercializador, y se suele equiparar a medicamentos similares que podamos enontrar em el punto de venta.
3. El precio se fija de forma libre y por ende es oscilante, pero siempre a la alza, desgraciadamente para el consumidor.
4. El consumo de medicamentos no reembolsables esta intimamente ligado a dos factores del pais, a saber:
A. La Renta per Capita del Pais: A mayor renta mayor consumo de medicamentos OTC’s.
B. El nivel de paro, ya que el consumo de productos OTC’s va asociado a manores tasas de desempleo; hay mas tiempo para ir al centro de salud y obtener el mismo medicamento u otro similar del mismo grupo terapeútico, por mas de un 25% del precio del OTC…
5. El espectro de los OTC’s en la farmacia española, es el reflejado según fuente IQVIA, Febrero 2024:
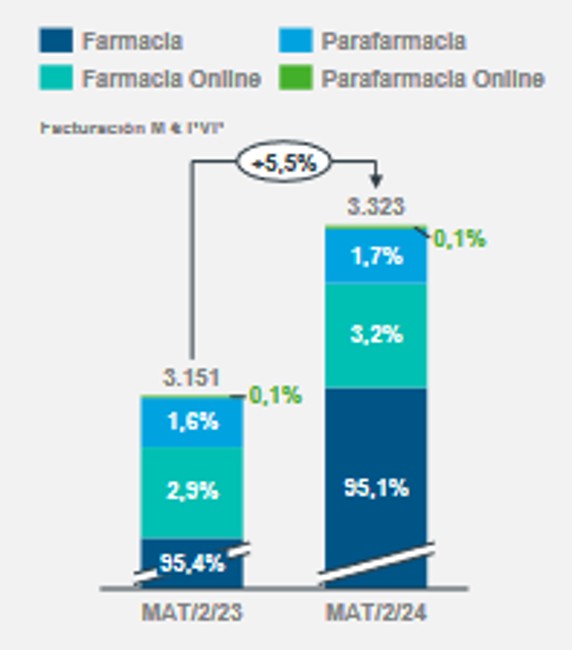
6. En los medicamentos OTC no existe la intervención de un médico, estamos ante la Automedicación.
7. Dicha Automedicación nos hace mover nuestra hoja de ruta desde una promoción basada en el médico prescriptor, a una promoción bicefala de dos pilares estructurales:
A. Buscar la recomendación del Farmaceútico del producto.
B. Realizar una actividad DtC ( Direct to to Consumer ), atraves de determinadas tácticas de promoción tales como PLV’s ( Publicidad en el lugar de venta ) Televisión, radio y otros medios, etc…. y así concienciar a los pacientes sobre la elección de productos, cuyas as etiquetas, los folletos y la publicidad para el consumidor tienen una importancia especial.
8. La competitividad del producto en el mercado OTC se basa en una de las cosas mas dificiles, largas y caras que existen, que es la creación de Marca.
9. Existen 4 grandes grupos m divididas en 15 areas de desarrollo, del concepto del autocuidad, tal como se describe en el siguiente esquema, fuente de WSMI 2007:
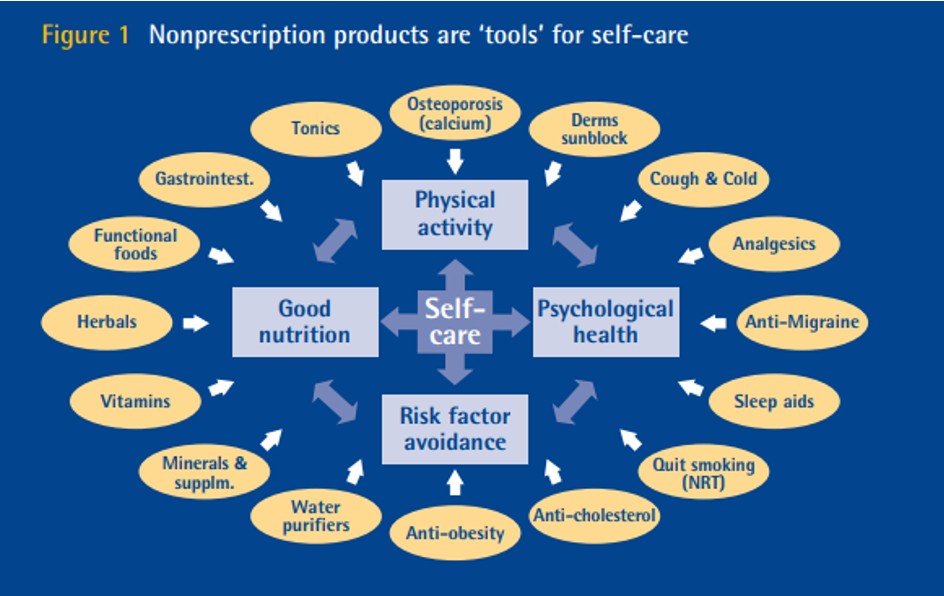
10. Actualmente, la World-Self Medical Industry nos indica para qué padecimientos inicialmente podrían ser considerados medicamentos sin prescripción médica, por su capacidad de autodiagnóstico y autocuidado (figura 1).
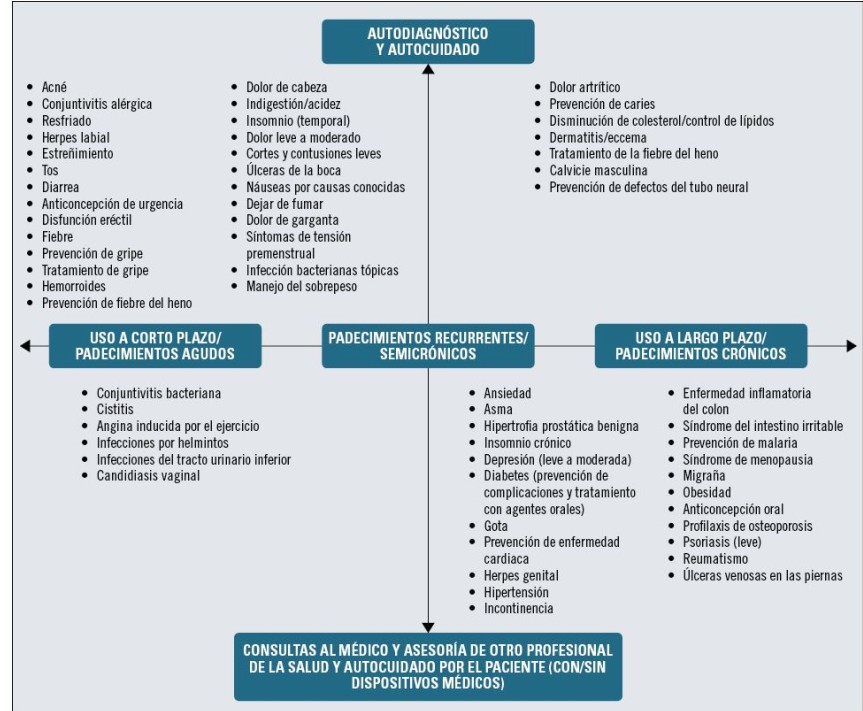
11. Cuando un paciente se va a autodiagnosticar, o va a buscar la recomendación farmacéutica para la elección de un medicamnetos, dicho diagnostico debe estar basado solo y únicamente en el Sintoma, es síntoma es el centro geográfico para la elección. Por ello, el switch de medicamentos no basados en el sintoma, nos va a suponer un camino largo, duro y proceloso…., tales como la prevención, wellness y otras areas de ‘’automedicación’’ p mejor llamado ‘’ autoingesta’’.
12. Crear una diferenciación del producto respecto a la competencia es fundamental, sobre todo en lo que se refiere en apoyarse en la rapidez de acción contra al síntoma.
13. Se debe de consultar de forma prevía, a los prescriptores, respecto al posible switch.
14. Debemos de tener paciencia, preparar un buen plan de marketing, contar con bastantes fondos y movernos en un area diferente, donde muhcos criterios, tácticas y actividades que desarrollabamos en los medicamentos con receta ya no son aplicables, y a veces, incluso, contraproducentes.
Como nota interesante, según Nielsen HealthScapeTM en una investigación del 2008, la mayor parte de Zyrtec OTC las ventas de switch (84%) llegaronde otros OTC
productos y sólo el 27% de prescripción de Zyrtec los pacientes se trasladaron a Zyrtec OTC..
Algunos ejemplos, según VMI son los enmarcados en el siguiente cuadro:

Bien, y hasta aquí conceptos , creo importantes, vayamos a tocar, de forma succinta, la esencia clínica y regulatoria que lidera las normativas que debemos de aplicar para el cambio de estatus del medicamento, y que podemos resumir en:
1. Todo medicamento debe ser Seguro y Eficaz.
2. La falta de seguridad, sea consecuencia de la razón que sea, nos puede conducir a una toxicidad y por ello a la aparición de efectos adversos no deseados.
3. No esta permitido el switch en determinados activos, tales como los estupefacientes y psicotropos.
4. Fundamental conocer la posible generación de dependencia en el consumidor, comoi elemento clave para obtener un switch.
5. Un elemento critico para la obtención del swithc es el demostrar, a tarves de los datos de Farmacovigilancia mundiales, que el principio activo no ha generado en un periodo largo de tiempo ( Algunos paises consioderas 15 años mínimo ) ningún efecto muy grave o grave.
6. Básico tener en consideración la dosis diaria máxima, dosis terapeútica, dosis tóxica y la via de administración.
7. Se debe preparar una documentación al paciente muy clara, concisa, legible y libre de interpretaciones y confusiones.
Así acabamos acuñando lo elementos esenciales para el switch:
A. Seguridad
B. Eficacia
C. Toxicidad
D. Dependencia
E. Autodiagnostico
F. Automedicación
G. Autocuidado
H. No intervención del Medico
I. No existe seguimiento del tratamiento
J. Dispensación farmacéutica
K. Tiempo de medicamento en el mercado
Y cuáles son los criterios regulatorios que un medicamento debe cumplir para considerar su switch?
Según la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ‘’Un medicamento no sujeto a prescripción médica debe considerar «procesos o condiciones que no necesiten un diagnóstico preciso y cuyos datos de evaluación toxicológica, clínica o de su utilización y vía de administración no exijan una prescripción médica’’.
Respecto a la legislación aplicable tenemos la norma europea ‘’ A Guideline on changing the classification for the supply of a medicinal product for human use’’, del mes de Enero de 2006, estruturada en 5 partes:
1) Criterios para clasificar un medicamento como sujeto a receta médica o no y cómo determinar si un medicamento no cumple estos criterios y por tanto no puede estar sujeto a prescripción médica.
2) Información y datos requeridos.
3) Exclusividad de datos para los datos presentados para un “cambio” del estatus legal de una medicamento de prescripción a sin prescripción (cambio en clasificación).
4) Principios y procedimientos para los datos presentados para un “cambio” del estatus legal deun medicamento de prescripción a sin prescripción (cambio en clasificación ).
5) Nombe del medicamento
Sin entrar en detalle, pero dando una vision aerea de los cirterios (Parte 1) encontramos los siguientes:
-
Riesgo directo y perfil de seguridad
-
Riesgos indirectos
-
Autodiagnostico
-
Riesgo y consecuencias del uso incorrecto
-
Información para el paciente
-
Interacciones
-
Tiempo desde la autorización y experiencia sobre el producto.
-
Si se refiere a nuea potencia, dosis, ruta de administración, indicación y combinanción.
Respecto a los documentos a presentar , debemos preparar:
1. Documento sobre no Clinica y Clínica Overview ( Informe de Expertos )
2. Docuemento sobre Seguridad clínica y no clínica
3. Evidencia de Eficacia clínica
4. Información detallada sobre el producto
Remarcar que para un nuevo switch podemos conseguir la exclusividad en el mercado de 1 año…..( Parte 3 ).
Transponiendo a nuestro pais, podeis consultar el documento de la AEMPS, cuyo marco legal de referencia es el siguiente:
* Ley 29/2006, de 29 de junio, de garantías y uso racional de los medicamentos y productos sanitarios. Artículos 19 y 78.
* Real Decreto 1345/2007, de 11 de octubre, por el que se regula el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano fabricados industrialmente. Artículos 24 y 25
* A Guideline on changing the classification for the supply of amedicinal product for human use - Directriz de la Comisión Europea sobre el cambio de clasificación para la dispensación de un medicamento de uso humano (revisión de enero 2006)
Dicho documento oficial emumera:
CONDICIONES PARA CONSIDERAR UN MEDICAMENTO COMO NO SUJETO A PRESCRIPCIÓN MÉDICA
- Que vayan destinados a procesos o condiciones que no necesiten un diagnóstico preciso y cuyos datos de evaluación toxicológica, clínica o de su utilización y vía de administración no exijan prescripción médica.
CONDICIONES PARA CONSIDERAR UN MEDICAMENTO COMO PUBLICITARIO
- Que no se financien con fondos públicos.
- Que no contengan en su composición sustancias psicotrópicas ni estupefacientes.
- Que por su composición y objetivo estén destinados y concebidos para su utilización sin la intervención de un médico que realice el diagnóstico la prescripción o el seguimiento del tratamiento.
El dossier de solicitud incluirá los siguientes apartados:
1. Solicitud con exposición de motivos
2. Informe de experto: seguridad – eficacia
3. Documentación demostrativa de su amplia seguridad y eficacia para la/s indicación/indicaciones y dosis solicitadas
4. Datos sobre Farmacovigilancia Situación internacional como medicamento no sujeto a prescripción médica y/o como medicamento publicitario (certificados de las autoridades sanitarias).
5. Propuesta, en español, de Ficha técnica y Prospecto para España como medicamento no sujeto a prescripción médica y/o medicamento publicitario.
Espero que este artículo haya sido útil, y si tenéis alguna duda, ya sabéis donde estoy, y mucha suerte en los switchs.
























