En los últimos años, la comercialización de medicamentos innovadores, frecuentemente de elevado coste, ha generado un reto para la gestión del presupuesto farmacéutico en los diferentes sistemas sanitarios españoles. Es evidente que el aumento poblacional, unido al aumento de la esperanza de vida, hace que este reto financiero se incremente con el tiempo.
Cada vez con mayor frecuencia, surgen fármacos innovadores con nuevos mecanismos de acción en diferentes áreas terapéuticas, capaces de aportar mejoras clínicas y de calidad de vida para los pacientes, por lo que su incorporación en la cartera de servicios no es cuestionable. A pesar de esto, los recursos sanitarios son limitados, por lo que el coste de la innovación podría llegar a exceder lo que nuestro sistema de salud puede soportar. Esta realidad hace necesario buscar sistemas que garanticen un acceso racional a la innovación, centrado en aportar beneficio a la población que así lo requiera, pero que a su vez permita mantener la sostenibilidad presupuestaria de los sistemas de salud.
Así pues, parece clara la necesidad de priorizar el acceso a la “verdadera” innovación, favoreciendo el acceso de estos fármacos que realmente suponen un beneficio claro en el tratamiento de los pacientes, y mediante mecanismos que permitan gestionar su impacto financiero para el sistema.
Para equilibrar los precios y el valor de los productos con la accesibilidad y el acceso a los medicamentos, la colaboración entre los diferentes decisores/pagadores y la industria farmacéutica ha de ser cada vez más estrecha, comprometiéndose, en ambos casos, a un acceso responsable de los medicamentos. Es necesario explorar y aplicar modelos financieros innovadores, disponer de mecanismos que permitan demostrar el valor de producto durante todo su ciclo de vida (Real World Evidence; RWE) y ser flexibles ante los continuos cambios en las políticas de salud. En este contexto, romper el paradigma del precio de los medicamentos es esencial para explorar enfoques innovadores, es decir, pasar de las negociaciones basadas exclusivamente en el precio, considerando solo el coste farmacéutico, a acuerdos más amplios, centrados en beneficio y resultados en salud.
Durante los últimos años se han desarrollado diferentes acuerdos innovadores a distintos niveles del sistema sanitario español, lo que ha generado una primera experiencia de gestión no basada exclusivamente en precio, sino en beneficio aportado por el fármaco. Los acuerdos innovadores resultan un interesante instrumento de gestión sanitaria que equilibra y pone de acuerdo a las dos partes de la balanza: proveedor y financiador, con un objetivo común: el beneficio del paciente. Los acuerdos innovadores persiguen compartir el riesgo que supone para la industria el tiempo requerido para la introducción del medicamento en el mercado, mientras que, para el sistema, representan una herramienta de gestión del riesgo asociado a una posible incertidumbre en resultado y una gestión de costes en práctica clínica habitual.
Si nos centramos en los acuerdos innovadores basados en resultados en salud, éstos permitirían posibilitar el acceso a la innovación y el control del coste sanitario, resolviendo una eventual incertidumbre clínica, de forma que el riesgo de facilitar el acceso a los pacientes sería compartido entre industria y sistema. Además, este tipo de acuerdos permitirían facilitar el control del presupuesto sanitario, haciéndolo más predecible, y su implementación, gestionada a través de protocolos de actuación, daría lugar a un acceso dirigido a la población más adecuada.
En general, la implementación de acuerdos innovadores se ha generado a nivel hospitalario, aunque su extensión ha permitido llegar a negociaciones de ámbito regional e incluso nacional, en lo que podríamos definir como una evolución “bottom-up”. Así, en el año 2011 se firmó el primer acuerdo innovador basado en resultados de salud en España, en el Hospital Virgen de las Nieves (Granada)1. Este acuerdo, firmado con la compañía farmacéutica GSK, permitió un ahorro de más de ocho millones de euros al Hospital. Posteriormente, se extendió su uso a nivel regional, siendo Cataluña una de las regiones más activas en el desarrollo de estos acuerdos. En 2013, el Hospital Clínico de Barcelona y la empresa farmacéutica UCB Pharma firmaron un acuerdo innovador para el medicamento Cimzia® (certolizumab pegol) indicado para el tratamiento de la artritis reumatoide2. Desde entonces, han sido 18 los acuerdos firmados para 10 principios activos, incluyendo 6 indicaciones en 3 áreas terapéuticas distintas. Sólo en Cataluña, 28 centros se han sumado ya a esta nueva iniciativa contractual.
Los términos contractuales de los acuerdos innovadores tienen carácter confidencial, pero los resultados de los mismos pueden encontrarse disponibles. Un ejemplo es gefitinib, para cáncer de pulmón no microcítico avanzado o metastásico, y los resultados del análisis de las consecuencias financieras de un esquema de pago por resultados del primer convenio de acuerdo de riesgo compartido a tres bandas entre el ICO (Institut Català d’Oncologia), AstraZeneca y CatSalut3. Los resultados del modelo de pago por resultados en comparación con el sistema tradicional (pago por producto) generaron un retorno para el sistema sanitario público del 4,15% del coste del tratamiento. Además, los resultados clínicos obtenidos bajo este modelo de financiación han igualado los resultados del ensayo clínico pivotal del medicamento. Estos resultados refuerzan la política del Departamento de Salud de acuerdo con la línea 5.3 del Plan de Salud de Cataluña 2016 hasta 2020 de impulsar la compra y financiación de medicamentos por resultados4.
Los beneficios de los acuerdos innovadores centrados en resultados en salud podrían resumirse en tres aspectos principales: (i) mejora de la gestión económica y administrativa del hospital, (ii) ventajas de control presupuestario y (iii) la implicación positiva para la salud, en términos de efectividad y calidad de vida para los pacientes. A pesar de esto, los acuerdos innovadores centrados en resultado en salud cuentan con una importante limitación, que corresponde a su implementación efectiva en la práctica clínica habitual. Implementar y mantener este tipo de acuerdos supone compromiso e implicación por parte de los centros de salud, así como destinar los recursos más adecuados para el desarrollo de los mismos. Es necesario mejorar el contexto normativo y organizativo sanitario, así como asumir la posible complejidad de gestión que pueden incorporar los acuerdos innovadores, de forma que no suponga una barrera para extender su uso.
El Ministerio de Sanidad ha sido el último en mostrar interés para incorporar este tipo de acuerdos para la financiación de fármacos innovadores. Este organismo ha mostrado un incremento de su transparencia en lo que se refiere a las decisiones de financiación de fármacos. De acuerdo con las notas informativas de la Comisión Interministerial de Precios de los Medicamentos (CIMP) celebradas entre Julio 2018 y Julio 20195, la información facilitada ha ido completándose progresivamente, incluyendo, desde la sesión celebrada el 31 de Noviembre de 2018, el precio financiado, y a partir del 25 de abril de 2019, los criterios en los que se basa la decisión positiva o negativa de financiación.
Durante el último año (2019), las decisiones desfavorables respecto a la financiación pública de medicamentos han superado a las favorables: 98 negativas frente a 87 favorables. Durante ese mismo periodo, 20 decisiones inicialmente desfavorables se han convertido en favorables, implicando una extensión del periodo de negociación de precio de 121 días adicionales. En las 87 decisiones positivas de financiación, estaban incluidos 33 medicamentos de uso o dispensación hospitalaria, de los que a 15 (45,5%) se les aplicó alguna condición especial de financiación, siendo la más habitual, el seguimiento, pero también otras como pago por resultados/riesgo compartido, techo de gasto, protocolo fármaco-clínico, registro de pacientes, suministro de determinados pacientes sin coste, grupos de riesgo y coste máximo por paciente5, todas ellas variantes de lo que podemos considerar acuerdos innovadores y que consolidan el interés del Ministerio de Sanidad por extender la utilización de este tipo de acuerdos en nuestro país.
El interés existe, y las iniciativas son cada vez más frecuentes, pero para conseguir un avance más rápido y eficaz, es imprescindible, además de considerar los resultados de salud, tener una visión más profunda y viable de los procesos clínicos. Comprender el contexto, forjar alianzas, generar evidencias, permitir el cambio y apostar por el valor del producto desde una perspectiva integral, constituye el punto de partida para el avance y desarrollo.
Estamos viendo cambios importantes en el comportamiento y las expectativas que los pacientes tienen frente a sus tratamientos, pero, sobre todo, en sus demandas. Por ello, resulta imprescindible enfocar la evaluación y la incorporación de la innovación a sus necesidades. Mejorar el manejo del paciente permitiría definir una propuesta de valor considerada y beneficiosa para todas las partes interesadas implicadas.
Una política orientada a los resultados permite por un lado la participación y la implicación de los profesionales y, por otro, posibilita un sistema de pago del medicamento que hace corresponsable de los resultados al laboratorio farmacéutico lo que permite obtener un retorno económico por parte de estos cuando el resultado, no es el esperado, suponiendo un ahorro para el sistema. La cooperación entre instituciones puede, no solo simplificar el proceso, sino también acelerar el acceso a los fármacos innovadores, siempre que exista un consenso entre todas las partes implicadas: industria, clínico, farmacéutico y el gestor público, convencidos de la utilidad de un esquema colaborativo.
Finalmente, la base imprescindible para cualquier acuerdo innovador, centrado en fármaco innovador, requiere de una definición pactada de lo que significa “innovación”, incluyendo los términos que comprende y la forma en la que se miden.
En este sentido, en una reciente publicación de IQVIA en colaboración con la Federación Europea de la Industria y Asociaciones Farmacéuticas (EFPIA), se propone un nuevo marco de valores y de terminología para capturar el valor completo de la innovación 6, basado no sólo en resultados con las medidas clásicas a nivel clínico o de coste y eficiencia, sino también en la experiencia de uso de los fármacos.
La innovación terapéutica debe demostrar un incremento de valor para el sistema de atención médica al mejorar la experiencia de uso de las personas involucradas (p.e. pacientes, cuidadores, proveedores de servicios sanitarios) y, a menudo, también directa o indirectamente entregando beneficios de resultados. Se propone un marco denominado innovaciones terapéuticas centradas en las personas, definido como una serie de innovaciones que aumenten el valor del sistema de salud, a través de la mejora en la experiencia de las personas implicadas (pacientes, cuidadores, profesionales sanitarios) y frecuentemente proporcionando beneficios clínicos de forma directa o indirecta6, Figura 1.
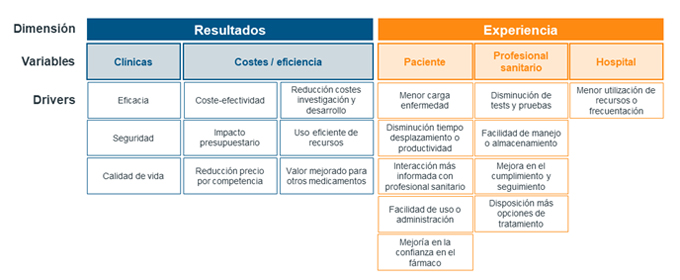
Figura 1. Propuesta de marco de evaluación de innovaciones terapéuticas centradas en la persona
Fuente: Assessing Person-Centered Therapeutic Innovations Final SummaryReport – 2019. White paper IQVIA
La percepción de estas dimensiones y variables es diferente para los distintos agentes implicados en el proceso: evaluadores/pagadores, profesionales sanitarios y pacientes.
En conclusión, el avance para la incorporación de innovación, de forma sostenible, en un sistema sanitario como el nuestro, requiere de un avance para incorporar nuevas dimensiones en el proceso de financiación, fomentando el uso de nuevas herramientas de negociación y acuerdo entre industria y sistema, así como una implicación activa de los usuarios finales de los medicamentos en el proceso de evaluación de fármacos. La evidencia debe ser el eje del cambio, considerando los diferentes momentos de la terapéutica y el ciclo de vida de los medicamentos, de forma que pueda llevarse a cabo un análisis real y objetivo de sus beneficios aportados a lo largo del tiempo. La financiación de medicamentos debe resultar en una inversión en salud, por encima de un ahorro de costes, poniendo el beneficio clínico como base para el establecimiento de acuerdos de financiación que permitan el acceso al tratamiento más adecuado, sin poner en riesgo la sostenibilidad del Sistema.
Bibliografía
1. Nueva Era de la Farmacia Hospitalaria: Gestionar la incertidumbre y compartir riesgos. Universidad Internacional Menéndez Pelayo. Santander 26 y 27 de junio de 2014. .
2. Rojas García P AVF. Los contratos de riesgo compartido en el sistema nacional de salud: percepciones de los profesionales sanitarios. Rev Esp Salud Publica. 2018;92.
3. CatSalut. Servicio Catalán de la Salud. Esquemas de Pago basados en Resultados (EPR).
4. Generalitat de Catalunya. Departament de Salut. Pla de salut de Catalunya 2016-2020 2016.
5. Comisión Interministerial de precios de medicamentos y productos sanitarios. Notas informativas de julio 2018 a julio 2019 (números 184 a 193)
6. IQVIA European Thought Leadership LEVwp.



















