
¿Cuál es el objetivo de la farmacovigilancia veterinaria?
La farmacovigilancia veterinaria tiene como objetivo principal la supervisión y mejora de la seguridad de los medicamentos de uso veterinario, con especial referencia a las reacciones adversas en animales y seres humanos relacionadas con el uso de estos medicamentos. Esta supervisión y evaluación implica, también, la recopilación de información disponible relacionada con la falta de efectividad, acontecimientos adversos debidos a un uso no incluido en la ficha técnica/prospecto del medicamento (uso off-label), la investigación sobre la validez del período de retirada y cualquier problema medioambiental potencial derivado del uso del producto.
El sistema de farmacovigilancia veterinaria en la Unión Europea (UE) se mantiene con la gestión y participación de las autoridades nacionales competentes (CAs), la Comisión Europea (CE) y la Agencia Europea de Medicamentos (EMA), en colaboración con los titulares de las autorizaciones de comercialización (TACs) de los medicamentos, teniendo en cuenta los aportes que en materia de reportes de acontecimientos adversos realicen profesionales sanitarios en la práctica veterinaria y los cuidadores en general.
En los últimos años, las autoridades reguladoras han llevado a cabo una exhaustiva revisión para actualizar y, así, dotar de un mayor rigor al sistema de farmacovigilancia veterinaria. Esta renovación debe facilitar la labor del profesional sanitario y farmacéutico, así como promover el desarrollo de medicamentos veterinarios más seguros y eficaces, mejorando así la salud y el bienestar animal y, por ende, de los seres humanos.
Nueva legislación sobre farmacovigilancia veterinaria y cambios con respecto a la anterior
A partir del 28 de enero de 2022, el Reglamento de Medicamentos Veterinarios (Reglamento (UE) 2019/6) sustituye a la Directiva 2001/82/CE, y modifica, a su vez,las medidas del Reglamento (UE) 726/2004 relativas a la autorización y supervisión de los medicamentos veterinarios. Además, junto con la implementación del Reglamento (UE) 2021/1281 de la CE se actualiza el actual sistema de farmacovigilancia veterinaria vigente en la UE, anteriormente recogido en el Volumen 9B de The Rules Governing Medicinal Products in the European Union (EU): Guidelines on Pharmacovigilance for Medicinal Products for Veterinary Use, con el objetivo de reducir la carga administrativa de la industria farmacéutica y las agencias reguladoras, al tiempo que se refuerza el enfoque científico de las actividades de monitorización de cuestiones de seguridad.
De esta manera, las nuevas guías de buenas prácticas de farmacovigilancia veterinaria (Veterinary Good Pharmacovigilance Practices, VGVPs), constituidas por seis módulos, recogen los principales cambios centrados principalmente en el reporte de presuntos acontecimientos adversos, la gestión y detección de señales, el mantenimiento del archivo maestro de farmacovigilancia (Pharmacovigilance Safety Management File, PSMF), la inclusión de inspecciones de farmacovigilancia, y la actualización de la base de datos de la Unión sobre medicamentos veterinarios (UPD) por parte de los TACs ,en cuanto al estado de autorización de los productos veterinarios y algunas variaciones. En el siguiente cuadro quedan recogidos estos cambios principales:
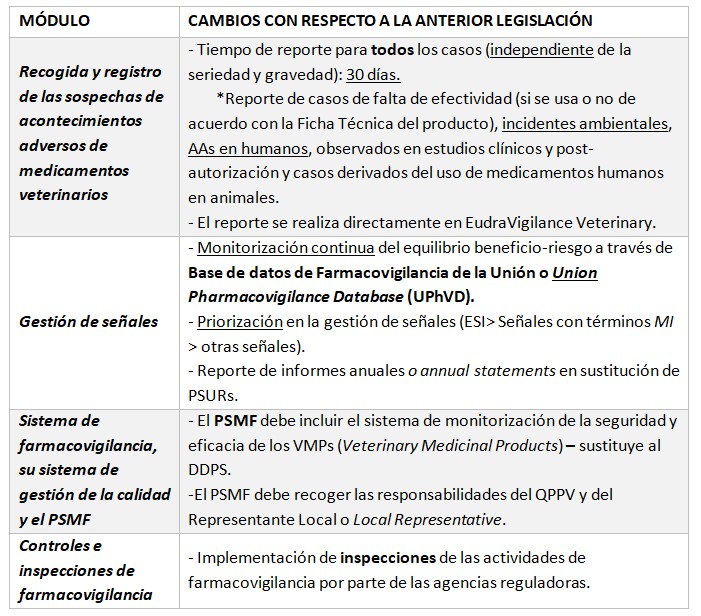
*EVVet3: EudraVigilance Veterinary 3; UPhVD: Union Pharmacovigilance Database; ESI: Emergency Safety Issues; MI: Medically Important; VMPs: Veterinary Medicinal Products; DDPS: Detailed Description of the PV System; AAs: Acontecimientos adversos; PSMF: Pharmacovigilance System Master File o Archivo Maestro de Farmacovigilancia.
Se incluye, también, un módulo correspondiente a la Comunicación en Farmacovigilancia Veterinaria, en el cual se trata la difusión activa de información específica sobre la seguridad de los medicamentos veterinarios, dirigida al público general, por parte de los TACs, las CAs y la EMA, con un enfoque específico en los veterinarios y un módulo correspondiente al Glosario de términos.
EudraVigilance Veterinary y la implementación de las bases de datos de la Unión
A partir del 28 de enero del 2022, la EMA puso en marcha el sistema EudraVigilance Veterinary (EVVet3), elemento esencial de la UPhVD, dotado con una nueva interfaz más intuitiva y actualizada para procesar y gestionar los reportes de farmacovigilancia veterinaria. EVVet3 utilizará las guías de notificación en farmacovigilancia desarrolladas por la Conferencia Internacional de Harmonización Veterinaria (VICH), específicamente las VICH GL42, VICH GL35 y VICH GL30, que sustituirán al formato de datos descrito en la Guía sobre elementos de datos (DEG) vigente anteriormente, así como la terminología VedDRA publicada por el Comité de Medicamentos para Uso Veterinario. Dichos reportes de presuntos acontecimientos adversos podrán ser monitorizados en la EVVet Data WareHouse (DWH), como parte del proceso de monitorización continua y detección de señales adoptado en la nueva legislación.
Además, es de especial importancia hacer referencia a otra de las implementaciones de la nueva legislación, la base de datos de la Unión sobre medicamentos veterinarios o Union Product Database (UPD). La UPD, que se basa en los cuatro servicios de gestión de datos SPOR (Substances, Products, Organizations and Referentials) y la cual se encuentra interconectada con la UPhVD, permitirá a los TACs realizar actualizaciones referentes a cambios de la autorización de comercialización de sus productos (suspensión, revocación), así como información referente al volumen de ventas de los mismos, lo cual deriva de la estrategia de la EMA para hacer frente al consumo excesivo y no apropiado de antimicrobianos (incluyendo antibióticos) y, por tanto, asegurar la efectividad de los mismos y a la aparición de nuevas resistencias.
Grupo de Expertos en Gestión de Señales Piloto
En función de las disposiciones del Reglamento (UE) 2019/6 en lo referente a la gestión de señales en la UE, los Estados miembros y la EMA tienen el deber de organizar los procesos relacionados con la gestión de señales para los VMPs autorizados en la UE. Con este fin, surge el Grupo de Expertos en Gestión de Señales Piloto (P-SMEG), creado por la cooperación entre la EMA y los Jefes de las Agencias de Medicamentos (Heads of Medicines Agencies, HMA). Sus principales cometidos engloban establecer y testar nuevos procesos relativos a la gestión de señales, así como identificar, priorizar y evaluar los problemas de seguridad utilizando toda la información disponible en la UPhVD. Otra de sus funciones consiste en servir de apoyo en la gestión de señales específicas, colaborar con el Veterinary Pharmacovigilance Working Party (PhVWP-V), así como contribuir a la preparación de formaciones para CAs y partes interesadas.
De esta manera, el P-SMEG constituye una herramienta de gran utilidad para los TAC en su labor relacionada con la gestión de señales.
QualitecFarma – Servicio de Farmacovigilancia Veterinaria
En los últimos años, la farmacovigilancia veterinaria ha adoptado una importancia notable dada la sustancial necesidad de proteger y garantizar la seguridad de animales, medio ambiente y seres humanos.
QualitecFarma da soporte a las empresas farmacéuticas y biotecnológicas desde hace más de 20 años, incluyendo un equipo de profesionales altamente cualificados para la realización de actividades de farmacovigilancia, incluidos medicamentos de uso veterinario basándonos en los últimos avances legislativos y tecnológicos aplicables.
Si eres titular de la autorización de comercialización de medicamentos veterinarios y requieres de soporte profesional en actividades de farmacovigilancia veterinaria, no dudes en ponerte en contacto con nuestro equipo de farmacovigilancia.
Referencias bibliográficas
- Regulation (EU) 2019/6 of the European Parliament and of the Council of 11 December 2018 on veterinary medicinal products and repealing Directive 2001/82/EC”.
- Commission Implementing Regulation (EU) 2021/1281 of 2 August 2021 laying down rules for the application of Regulation (EU) 2019/6 of the European Parliament and of the Council as regards good pharmacovigilance practice and on the format, content and summary of the pharmacovigilance system master file for veterinary medicinal products.
- Real Decreto 1157/2021, de 28 de diciembre, por el que se regulan los medicamentos veterinarios fabricados industrialmente.
- Guidelines on Veterinary Good Pharmacovigilance Practices (VGVP) – Module: Collection and recording of suspected adverse events for veterinary medicinal products.
- Guidelines on Veterinary Good Pharmacovigilance Practices (VGVP) – Module: Signal Management.
- Guidelines on Veterinary Good Pharmacovigilance Practices (VGVP) – Module: Veterinary Pharmacovigilance communication.
- Guidelines on Veterinary Good Pharmacovigilance Practices (VGVP) – Module: Pharmacovigilance systems, their quality management systems and pharmacovigilance system master files.
- Guidelines on Veterinary Good Pharmacovigilance Practices (VGVP) – Module: Veterinary pharmacovigilance communication.
- Guidelines on Veterinary Good Pharmacovigilance Practices (VGVP) – Module: Glossary.


















