En los últimos años, el software se ha convertido en una herramienta esencial en la tecnología de la salud, revolucionando la atención al paciente. Se están utilizando varios tipos de software en entornos de atención médica, desde sistemas electrónicos eficientes para almacenar información del paciente hasta inteligencia artificial que puede realizar un diagnóstico con precisión.
Mientras que, en Europa, el primer ejemplo se consideraría software para fines generales, el último se clasificaría como dispositivo médico (MD) o dispositivo médico de diagnóstico in vitro (IVD). Este tipo de software se conoce generalmente como software como dispositivo médico (SaMD) o, más comúnmente en Europa, software de dispositivo médico (MDSW).
Entonces, ¿qué hace que el software sea un producto sanitario?
Según el Foro Internacional de Regulación de Dispositivos Médicos (IMDRF), MDSW se define como:
"software destinado a ser utilizado para uno o más propósitos médicos que realizan estos propósitos sin ser parte de un dispositivo médico de hardware".
En Europa (MDCG 2019-11), MDSW se define como:
"El software de dispositivos médicos es un software que está destinado a ser utilizado, solo o en combinación, para un propósito como los que se especifica en la definición de “producto sanitario” en la regulación de productos sanitarios o la regulación de productos sanitarios de diagnóstico in vitro".
Por lo tanto, el software con un propósito médico se considera un producto sanitario y, como tal, debe cumplir con el Reglamento de la UE 2017/745 (MDR) o el Reglamento de la UE 2017/746 (IVDR). En comparación con las directivas anteriores, las regulaciones tienen requisitos adicionales para MDSW. Para obtener el marcado CE para un MDSW, los fabricantes deben considerar tres pasos críticos:
Calificación del software como MD o IVD
El Artículo 2 del Reglamento de Productos Sanitarios especifica que el software autónomo es un producto sanitario si está destinado a ser utilizado por el fabricante para uno de los siguientes propósitos:
“-Diagnóstico, prevención, seguimiento, predicción, pronóstico, tratamiento o alivio de la enfermedad,
- diagnóstico, seguimiento, tratamiento, alivio o compensación de una lesión o discapacidad,
- investigación, sustitución o modificación de la anatomía o de un proceso o estado fisiológico o patológico,
- proporcionar información mediante el examen in vitro de muestras obtenidas del cuerpo humano, incluidas las donaciones de órganos, sangre y tejidos”.
De manera similar, el Artículo 2 del Reglamento de Productos Sanitarios para Diagnóstico In Vitro define que el software es un IVD si se utiliza para proporcionar información sobre uno o más de los siguientes:
“-En relación con un proceso o estado fisiológico o patológico;
-En relación con las deficiencias físicas o mentales congénitas;
-En relación con la predisposición a una afección médica o una enfermedad;
-Determinar la seguridad y compatibilidad con los posibles destinatarios;
-Predecir la respuesta o reacciones al tratamiento;
-Definir o monitorear medidas terapéuticas ”.
En Europa, el software se puede calificar como MD o IVD independientemente del usuario (profesional sanitario o usuario general, individuo sano o enfermo), la tecnología utilizada (algoritmos complejos o simples) o su riesgo. La calificación del software como MD o IVD depende únicamente del propósito previsto del dispositivo y si cumple con la definición de MD o IVD en las regulaciones.
El software también se puede considerar MDSW si es un accesorio de un MD o IVD, o si está incluido en el Anexo XVI del Reglamento de Productos Sanitarios (dispositivos sin propósito médico). Otro aspecto importante para tener en cuenta es si el software realiza alguna acción sobre los datos que sea diferente al almacenamiento, archivo, comunicación o búsqueda simple.
De forma adicional a esta definición, la MDCG 2019-11 "Guía sobre calificación y clasificación de software" proporciona una figura con pasos de decisión para facilitar la calificación de software como MDSW. Más recientemente, MDCG ha publicado una infografía con el mismo propósito.
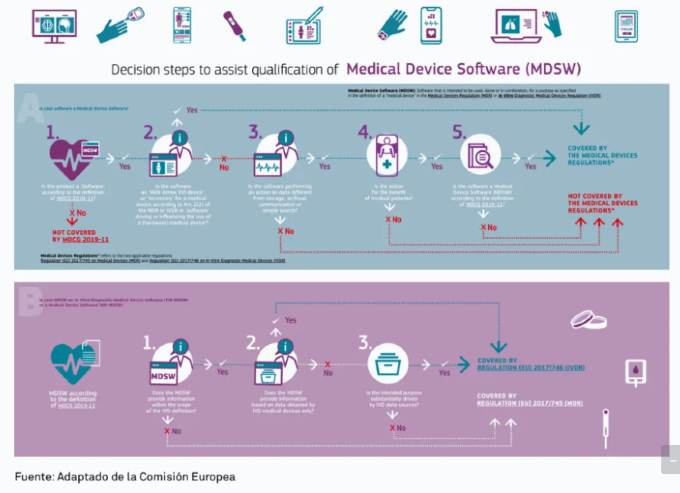
Fuente: Adaptado de la Comisión Europea
¿Qué pasa con las aplicaciones de fitness o bienestar?
Mientras que las aplicaciones de salud y bienestar brindan información sobre estilo de vida, estado físico o bienestar, MDSW brinda información para el tratamiento o diagnóstico de una enfermedad o condición clínica; tiene un propósito médico. La MDR menciona explícitamente que las aplicaciones de fitness o bienestar no son MDSW:
"El software para fines generales, incluso cuando se utiliza en un entorno de atención médica, o el software destinado a fines de estilo de vida y bienestar no es un dispositivo médico".
Una estrategia interesante para los fabricantes podría ser colocar en primer lugar su software en el mercado con fines de salud general y utilizarlo para ganar experiencia, recopilar datos sobre usabilidad y generar evidencia hasta que la evidencia sea suficiente para hacer una afirmación médica.
Observaciones finales
Sin lugar a duda, el aumento del uso de MDSW ha mejorado varios aspectos de la atención y el tratamiento del paciente. Los criterios de calificación detallados en la MDR, IVDR y MDCG 2019-11 abordan las brechas identificadas anteriormente. Además, la clasificación correcta y el cumplimiento de los requisitos específicos de MDSW completan la lista de pasos críticos para colocar con éxito un MDSW en el mercado al tiempo que se garantiza la seguridad del paciente y el rendimiento del dispositivo.
En AKRN Scientific Consulting SL somos expertos en MDSW. Nuestro equipo regulatorio experto puede ayudar a los fabricantes a preparar o actualizar la documentación requerida para cumplir con los requisitos de la MDR o IVDR para obtener o mantener el marcado CE.



















